서론
심폐운동부하검사(cardiopulmonary exercise test, CPET)는 점진적으로 운동부하를 증가시키면서 심박수(heart rate, HR), 혈압, 증상, 심전도를 모니터링하고, 호흡가스분석(ventilatory gas analysis) 결과를 분석하는 검사이다[1]. 운동에 대한 신체의 반응이 정상적인지 비정상적인지를 이해하기 위해 검사 과정 중 심장과 폐에 관한 정보를 수집한다. 최대 산소소모량 등으로 측정한 유산소운동능력치는 심혈관질환 환자의 예후와 연관되어 있으며, 심장재활 진행 전·후의 호전 정도를 통해 심장재활 효과 판정에도 이용되고 있다. 이에 심장재활 진료지침에서는 금기 사항이 아니라면 CPET를 시행할 것을 권고하고 있다[1].
호흡가스분석은 심장재활 환자의 운동 생리 상태와 심폐 기능을 평가하는 데 사용될 수 있다. 환자가 운동을 할 때 호흡 속도, 산소 소모량(oxygen consumption, V̇O2), 이산화탄소 생성량(carbon dioxide production, V̇CO2) 등의 지표를 측정하여 심폐 지구력과 심혈관 시스템의 기능을 평가하고 이를 최적의 운동 강도와 기간을 결정하는 데 반영할 수 있다. 또한 호흡가스분석을 통해 환자의 심폐 기능과 대사 활동을 고려하여 개인화된 운동 프로그램을 설계할 수 있다. 이렇게 최적의 운동 강도 등이 개별화된 운동 프로그램을 통해 환자의 심장 건강을 개선하고 심폐 기능을 향상시키는 데 도움을 줄 수 있다. 호흡가스분석은 심장재활 프로그램 진행 중에 환자의 심폐 기능 및 물리적 변화를 모니터링하는 데에도 사용될 수 있다. 이를 통해 프로그램의 효과를 평가하고 필요에 따라 조정할 수 있다.
호흡가스분석은 심장재활치료 과정 중 심폐 기능 평가, 운동 프로그램 개발, 그리고 프로그램 모니터링 등 다양한 측면에서 활용될 수 있다. 이를 통해 환자의 심장 건강을 개선하고 심근경색의 재발을 예방하는 데 도움이 된다. CPET의 검사 절차나 운동 프로토콜에 관하여서는 따로 설명하지 않겠으며 보다 자세한 내용은 운동부하검사에 관한 최신 문헌을 참고하는 것을 추천한다[2-4]. 본 종설에서는 임상에서 CPET 검사를 수행함에 있어 호흡가스분석을 해석하는 것을 중심으로 기술하고자 한다.
본론
CPET를 실시할 때는 treadmill 혹은 cycle ergometer를 많이 사용하며 운동의 부하를 주는 프로토콜이 여럿 존재한다[2]. European Association for Cardiovascular Prevention & Rehabilitation Representative 및 American Heart Association Representative에서 제안하는 CPET의 Universal Reporting Sheet는 호흡가스 분석결과가 필수적으로 필요하다[3].
CPET 중 실시하는 호흡가스 분석은 breath-by-breath법에 의해 1회 호흡마다 호기 가스를 측정한다. 에너지대사에 좌우되는 O2, CO2량이 폐에서 교환되는 양과 신체조직에서 사용되는 양이 일정하며 호흡가스 분석을 통해 소모되는 산소와 생성되는 이산화탄소의 양을 측정하게 된다. 호흡가스분석을 위해 호기가스를 수집하는 방법에는 전통적인 Douglas bag 방법, mixing chamber 방법, breath-by-breath법의 방법이 있다. 이 중 매 호기마다 가스를 분석하는 breath-by-breath법이 임상적 이용에 적합하다.
흡기와 호기의 O₂, CO₂ 가스 농도차에서 V̇O2와 V̇CO2를 측정한다. 또한 일회호흡량(tidal volume, VT), 호흡수(breathing frequency, BF), 분당 환기량(V̇E [minute ventilation] = VT × BF)을 측정한다. 이 측정값에서 호흡 교환 비율(respiratory exchange rate [RER] = V̇CO2 / V̇O2), 산소의 환기동등치(respiratory exchange rate [RER] ≈ V̇E / V̇O2) 및 이산화탄소의 환기동등치(EqCO2 ≈ minute ventilation [V̇E] / V̇CO2), V̇E / V̇CO2 기울기(slope) 등을 계산한다. 심전도와 혈압을 함께 측정하므로, heart rate (HR)와 V̇O2에서 산소맥(V̇O2 / HR)을 구한다.
CPET 검사 시 호흡가스분석의 주요 변수 및 그 변수 간의 상호 관계는 Wasserman 등은 9개 패널 그래프를 통해 체계적으로 제시하였고[5], 2012년에 교육 목적을 위해 원래의 9개 패널 디스플레이를 재배열했으며 내용은 동일하다[4,6]. 이 그래프는 신뢰성 있고 체계적인 해석과 테스트 결과의 현실적인 분포를 가능하게 한다. Fig. 1에서 cycle ergometer로 20 watt ramp protocol로 운동검사를 실시하면서 Quark CPET (COSMED, Napoli, Italia)을 이용해 호흡가스를 분석한 9 패널 그래프를 볼 수 있다(Fig. 1).
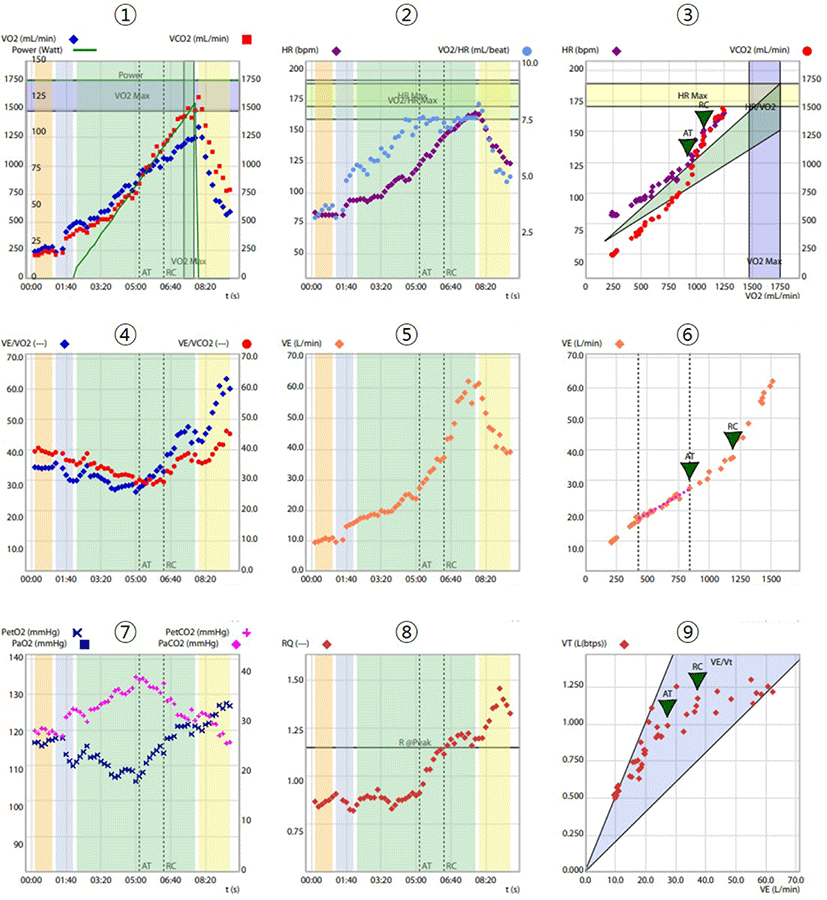
전체 CPET 검사 기간(휴식, 운동 및 회복 중)에 걸쳐 9개 패널 디스플레이를 체계적인 순서로 분석하는 것은 효과적인 방법이다. Fig. 1의 그래프 내용은 운동 중 생리적 반응에 따라 3가지 측면에서 분석될 수 있다. 산소 소모에 관한 정보는 패널 1, 2, 3, 8에 나타난다. 운동 중 호흡량과 제한은 패널 5, 9에 표시된다. 폐 가스 교환 및 ventilation/perfusion ratio (V/Q) 불일치에 관한 정보는 패널 4, 6, 7에서 확인할 수 있다[4]. CPET 변수의 수가 많기 때문에, 몇 가지 임상적으로 의미 있는 주요 변수로 축소하는 것은 정말로 주목할 만하며, 이로써 비전문가들도 9개 패널 디스플레이를 사용하여 체계적인 분석과 해석을 수행할 수 있게 된다.
CPET 중에 운동의 부하가 증가되어도 산소소모량이 더 증가하지 않은 것을 최대산소소모량(maximum oxygen consumption, V̇O2max)이라고 한다. 운동 중단 시 가장 높은 산소 소모량을 최고산소소모량(oxygen uptake achieved at end of exercise, V̇O2peak)이라고 한다. CPET를 중단하는 사유는 흉통, 부정맥, 호흡곤란, 하지의 피로 등 다양하지만, 어떤 사유에서든지 운동을 중단한 시점에서의 산소소모량이 V̇O2peak이며, V̇O2peak가 도달가능한 최대운동능력(V̇O2max)보다 운동 능력/성능과의 관련성이 더 높다[7].
Wasserman 패널 1은 V̇O2와 V̇CO2가 운동강도(work rate, WR)에 따라 변화하는 것을 보여준다(Fig. 1: panel 1). V̇O2peak는 운동 검사의 끝에서 측정하는 최대 운동 능력과 산소 섭취를 나타내며, 이 값이 최대 운동 능력을 반영하는 지는 환자의 노력에 결정된다. V̇O2peak은 장기 생존의 지표이다[8]. ΔV̇O2/ΔWR 비율은 운동에 대한 유산소 대사의 기여도, 즉 유산소 능력을 보여준다. ΔV̇O2/ΔWR 비율이 낮다면, 이는 운동 중 산소가 근육에 전달이 원활하지 않고 무산소 대사의 비중이 높다는 것을 나타낸다(예: 말초동맥, 심혈관, 폐혈관 및/또는 폐 질환).
RER은 시간에 따른 이산화탄소 생성과 산소 섭취의 비율(V̇CO2/V̇O2)이다. WR가 증가함에 따라 RER이 증가한다(Fig. 1: panel 8). RER은 점진적인 운동 중 젖산(lactate) 증가 속도와 관련되며, 운동검사에 참여하는 환자의 노력을 반영한다(최소한 RER ≥ 1)[3].
V̇O2peak값은 최대 운동 시 20초 또는 30초의 평균 데이터를 기반으로 하는 것이 바람직하다. 단 한번의 호흡이나 10초 미만의 데이터를 기반으로 V̇O2peak를 정해서는 안된다. 정상인에서 운동 중 V̇O2peak값은 연령, 성별, 체질량지수, 제지방질량, 평소 활동 수준, 운동 유형에 따라 다양하며, 나이와 성별이 크게 작용한다[9].
측정한 V̇O2peak값을 예측된(predicted) V̇O2peak값과 비교할 때는, 검사한 것과 동일한 유형의 운동(예: cycle, treadmill 등)에 대해 생성된 예측값을 사용해야 한다. 운동의 유형은 V̇O2peak의 중요한 결정 요소이다. Arm ergometer 운동 중의 V̇O2peak(대부분의 환자 평가에는 적절하지 않음)은 하지 cycle ergometer 운동의 약 70%이다. 이는 근육의 작은 질량과 달성 가능한 최대 WR이 낮기 때문이다. 하지 cycle ergometer 운동의 V̇O2peak는 걷기 운동의 V̇O2peak의 약 89%에서 95% 정도이다[10]. 따라서 하지 cycle ergometer 운동의 V̇O2peak를 예측할 때는 하지 cycle ergometer 운동과 관련된 근육 군을 고려해야 한다. Hansen/Wasserman의 하지 cycle ergometer 운동의 V̇O2peak 예측 공식은 다음과 같다[4].
-
Ideal weight (kg) for men = 0.79 × height (cm) - 60.7
-
Ideal weight (kg) for women = 0.65 × height (cm) - 42.8
-
For men, if actual weight equals or exceeds ideal weight: V̇O2peak = 0.0337 × height - 0.000165 × age × height - 1.963 + 0.006 × weight (actual-ideal)
-
For men, if actual weight is less than ideal weight: V̇O2peak = 0.0337 × height - 0.000165 × age × height - 1.963 + 0.014 × weight (actual - ideal)
-
For women: V̇O2peak = 0.001 × height (cm) × (14.783 - 0.11 × age) + 0.006 × weight (actual - ideal)
18-29세 환자의 참고값은 일반적으로 30세 환자의 참고치를 기준으로 사용하기 때문에, 이 연령대에서 V̇O2peak을 추정하는 참조 방정식을 사용할 때는 공식에 원래의 나이(18-29세) 대신 30세를 입력하여 참고치를 도출한다. 제시된 참고치는 비교적 앉아서 생활하는 남성과 여성에 대한 것이며, 운동선수나 격렬한 운동을 하는 사람의 경우 더 높은 값이 예상된다. 상대적으로 짧은 기간(2주)의 극도의 비활성은 대부분의 개인에서 V̇O2peak 값이 감소된다. 신체 활동 수준이 높은 사회의 경우 권장 예측 값이 너무 낮을 수 있다. 인종에 따라 예측치가 다르다는 증거는 없다[4].
세포 내 산소 소모와 에너지 대사는 생명 유지 및 기능 수행에 필요한 에너지원인 삼인산아데노신(adenosine triphosphate, ATP)을 생성하는 과정이다. 에너지 기질을 생산하는 과정에서 산소 사용 유무에 따라 유산소성 경로(aerobic pathway, oxidative phosphorylation)와 무산소성 경로(anaerobic pathway; ATP-phosphocreatine, glycolytic system)을 로 구분할 수 있다.
에너지 생성을 위해서는 먼저 포도당이 세포 내로 흡수되어 대사 과정을 시작한다. 해당작용(glycolysis)으로 포도당은 파이루브산으로 변환된다. 유산소성 과정은 세포 내의 미토콘드리아에서 이루어지며, 주로 미토콘드리아의 내막 내부에서 일어나게 되는데, 파이루브산이 미토콘드리아 내부로 들어가면 산소가 존재하는 환경에서 아세틸 보조효소A(acetyl CoA)로 분해된다. 아세틸보조효소A는 산소에 의해 분해되고, 이 과정에서 이산화탄소와 수소 이온이 생성된다. 이산화탄소는 호흡가스로서 배출되며, 수소 이온은 전이방식을 통해 전기적 그라데이션을 형성한다. 이 전기적 그라데이션은 미토콘드리아 내부와 외부의 양전하 차이로 인해 생성되는데, 전기적 그라데이션을 통해 생성된 에너지는 ATP 합성 효소인 ATP 합성효소에 의해 ATP로 변환된다. 이 과정을 산화적인 인산화(oxidative phosphorylation)이라고 한다.
운동 중 에너지는 유산소 대사를 통해 주로 에너지의 공급이 이루어지며, 운동강도(WR)가 무산소역치(aerobic threshold, AT)에 이르기까지 에너지를 공급하는 주된 기전이다. 운동강도 WR가 증가함에 따라 V̇O2와 V̇CO2는 증가한다(Fig. 1: panel 1). 운동 초기에는 V̇O2가 V̇CO2를 초과하는 것이 관찰되는데, 이는 에너지대사에서 생성된 CO2가 일시적으로 신체 내로 흡수되기 때문이다. V̇O2/HR은 각 심박동마다 조직에서 추출되는 산소 양을 나타낸다. 운동강도 WR가 증가함에 따라 HR, V̇O2/HR, V̇E가 선형적으로 증가한다(Fig. 1: panel 2, 5).
운동강도 WR가 계속 증가함에 따라 유산소 대사는 이미 최대한으로 활용되게 되면, ATP는 무산소 해당작용(anaerobic glycolysis)을 통해 생성하게 된다. 무산소 해당작용은 산소를 사용하지 않고 빠르게 에너지 공급이 가능하지만, 에너지 수율이 낮다는 단점이 있다(1 몰의 포도당 당 2 몰의 ATP 생성됨). 무산소 해당작용의 결과 산성을 띠는 젖산(lactate)이 최종적으로 생성되는데, 그 결과 생성된 수소 이온(H+)은 중성 pH를 유지하기 위해 탄산수소나트륨(HCO3–)에 의해 완충(buffer)되어 H2O과 CO2가 생성된다(H+ + HCO3– → H2O + CO2). 결과적으로 과도하게 생성된 CO2는 환기(ventilation)을 매우 강하게 자극하는 요인으로 작용하게 된다.
V̇O2는 운동강도 WR가 증가함에 따라 평행적으로 늘어난다. 반면, 과도하게 생성된 CO2로 인해 VE가 증가하게 되며, 증가한 환기를 통해 상당히 많은 CO2가 폐로 배출(V̇CO2↑)된다. 즉, V̇CO2는 이제 V̇O2보다 상당히 가파르게 증가하게 된다(AT)(Fig. 1: panel 3). 이 때, V̇E와 V̇CO2는 거의 비례적으로 증가하기 때문에 EqCO2(≈ V̇E/V̇CO2)는 비교적 일정하게 유지되거나 약간 감소하지만, V̇E가 V̇O2보다 상대적으로 더 크게 증가하기 때문에 EqO2(≈ V̇E/V̇O2)는 증가한다(Fig. 1: panel 4).
호기말 산소 또는 폐포 내의 산소분압(PETO2 ≈ PAO2) 역시 CO2 매개 환기로 인해 증가하며, 호기말 이산화탄소 또는 폐포내의 이산화탄소분압(PETCO2 ≈ PACO2)는 일정하게 유지되거나 약간 감소한다(Fig. 1: panel 7). V̇O2/HR는 WR의 증가와 함께 증가하다가 운동의 후기에서는 그 증가세가 감소하는데, 이 시기부터는 일회박출량(stroke volume)이 더 이상 향상되지 않지만 HR는 작업량 증가에 따라 선형적으로 상승이 지속된다(Fig. 1: panel 2).
무산소역치 AT의 측정에는 최대의 운동부하를 요구하지 않기 때문에 운동능력을 객관적으로 평가할 수 있다. 무산소역치 AT는 호흡가스분석을 실시하는 컴퓨터 프로그램을 통해 자동적으로 계산될 수 있지만 교차 확인이 필요하다. 패널 3, 4, 7의 정보를 결합함으로써 대부분의 경우 AT를 결정할 수 있다. 패널 3이 AT를 결정하는 데 맨 먼저 참고하는 자료이다(Fig. 1: panel 3). 무산소역치 AT는 V̇CO2가 V̇O2보다 지속적으로 가팔라지기 시작하는 지점이다(V-기울기 방법). 또한 CO2로 인한 과호흡이 생기는 지점이다. V-기울기는 PETO2 및 V̇E/V̇O2보다는 호흡 불규칙성에 덜 민감하다. AT의 유효한 결정은 항상 가능한 것은 아니며, 매우 심한 호흡 제한이나 중대한 심부전인 경우에는 증가하는 운동에 적절하게 반응하여 환기 및/또는 관류(perfusion)를 더 이상 충분히 증가시킬 수 없는 경우가 있다.
운동강도 WR가 더욱 증가함에 따라, 근육에 더 많은 젖산이 축적된다. 젖산과 연관된 수소 이온을 완충하는 완충 염기(buffer base)가 고갈되면서 대사성 젖산 산증(lactic acidosis; pH↓)이 발생하면 이로 인해 강한 중추성 환기 자극이 추가적으로 유발된다(대사성 산증에 대한 호흡보상점; respiratory compensation point, RCP). 과도하게 증가한 환기로 인해 더 많은 CO2가 배출되며(V̇CO2↑), V̇O2는 여전히 운동강도 WR에 비례하여 증가한다. RCP를 넘어서면 V̇E는 V̇CO2보다 더 빠르게 증가하여(V̇E/V̇CO2↑)(Fig. 1: panel 4), PETCO2은 감소하게 된다(CO2의 환기 제거가 증가함)(Fig. 1: panel 7).
과도한 환기 증가는 PETO2 및 두 개의 환기 동등치 EqO2 (≈ V̇E/V̇O2)와 EqCO2 (≈ V̇E/V̇CO2)를 상승시킨다(Fig. 1: panel 4). 무산소 범위에서는 V̇O2가 HR에 비해 상대적으로 감소하며 V̇O2/HR이 평탄해진다(Fig. 1: panel 2). 운동 종료가 점점 가까워지는 신호이다.
AT는 유산소-무산소가 복합된 대사로의 전환을 의미하며, 호흡보상점 RCP는 주요한 대사경로가 무산소 대사로 전환됨을 의미한다.
운동은 폐 혈류의 증가와 깊은 호흡에 의한 일회호흡량 VT의 증가를 통해 환기관류를 크게 증가시키는데, 이로 인해 기체 교환 영역이 넓어지게 된다. 이 기체 교환의 향상된 효율성은 EqO2 (≈ V̇E/V̇O2) 및 EqCO2 (≈ V̇E/V̇CO2)가 감소되는 현상으로 확인된다. 환기에 비해(V̇E) 더 많은 산소가 흡수되고(V̇O2↑) 더 많은 이산화탄소가 제거되기 때문이다(V̇CO2↑). 환기 동등치가 최저가 되는 지점(nadir)은 폐가 가장 효과적으로 작동하는 지점이라고 볼 수 있다(Fig. 1: panel 4).
환기와 관류의 비율은 폐에서 기체 교환에 있어서 결정적인 역할을 한다. 폐 질환, 폐 혈관 장애 및 심부전이 있는 경우 뚜렷한 V/Q 불일치(V/Q mismatch)가 나타난다[11]. 따라서 호흡가스분석은 운동능력 제한이 발생하는 병태생리를 이해하는 데 중요한 역할을 한다. 휴식 시에 환기는 중력으로 인해 폐의 첨부와 기저부 사이에 작은 경사가 존재하나, 관류는 그 경사가 더 뚜렷하다. 즉, V/Q가 첨부에서 높고(high V/Q) 폐의 기저부로 갈수록 낮아진다. 이로 인해 기체 교환이 효과적이지 않다. 운동 중에는 깊은 호흡과 혈관 확장, 이전에 닫혔던 모세관 활성화를 통해 폐의 상엽에서의 환기와 관류가 향상되어 이러한 V/Q 이질성이 줄어들고, 그 결과 가스 교환 영역이 확장된다.
V/Q 불일치는 크게 두 가지 형태 low V/Q 불일치와 high V/Q 불일치로 구분해 살펴볼 수 있으나 많은 경우 겹쳐서 나타나기도 한다.
첫번째 형태는 낮은 V/Q 불일치이다. 즉 환기/관류 비율이 낮은 형태이며, 불완전한 환기 장애 혹은 션트 효과라고도 한다. 환기가 잘 되지 않지만 혈액은 정상적으로 관류되는 폐포에서 발생한다(상대적인 저환기). 만성 폐쇄성 폐질환(COPD)과 제한성 폐질환(폐섬유증)에 나타난다. 산소화되지 않는 혈액이 폐정맥에서 혼합되면서 저산소혈증이 발생하며, 이것은 과환기로는 보상할 수 없어 폐포-동맥 산소분압 차이(P(A-a)O2)는 증가한다. 다만 V/Q가 낮은 것으로 인해 PaCO2의 상승까지는 일어나지 않는데, 이는 다른 폐포에서 과환기가 되어서 PaCO2의 상승은 예방되기 때문이다.
둘째는 높은 V/Q 불일치의 형태이다. 즉 환기는 잘 되지만 혈류가 나쁜 폐포에서(상대적인 과환기) V/Q 비율이 증가하게 된다(사강효과[VD/VT↑]). 예시로 만성 심부전, 폐혈관 질환이 있으며, 폐기종에서 과팽창으로 인한 혈관 압박, 모세혈관계가 감소된 간질성 폐질환 등이 포함된다. 전반적으로 높은 V/Q 불일치는 일반적으로 다른 폐포 영역이 보상적으로 과환기되기 때문에 동맥 혈액 가스에는 미미한 영향을 미친다. 다만, 폐포로의 CO2 방출이 손상되어 O2보다 CO2에 더 영향을 주고 이로 인해 동맥-호기말 이산화탄소분압 차이 (P(a-ET)CO2)가 증가한다.
극단적으로 V/Q = 0 (완전한 환기 장애; 예: 무기폐, 폐렴) 이거나 V/Q = ∞ (완전한 관류 장애; 예: 급성 폐색전증)인 형태의 V/Q 불일치는 임상 상황에서는 운동 검사가 불가능하기 때문에 CPET에서 실시하는 호흡가스분석에서는 주요한 고려사항은 아니다.
EqO2 (≈ V̇E/V̇O2) 및 EqCO2 (≈ V̇E/V̇CO2)는 1 L의 O2를 흡수하거나 1 L의 CO2를 내쉴 때 몇 리터를 환기해야 하는지 나타낸다(가스 교환 효율). 동등치 값이 낮을수록 가스 교환이나 호흡 작업이 더 효과적이라는 의미가 되고 반대도 마찬가지이다. 환기동등치(V̇E/V̇O2 혹은 V̇E/V̇CO2)가 과도하게 높은 것은 증가한 환기 욕구(비특이적 과호흡), 대사성 산증(보상적 과호흡), 혹은 V/Q 불일치(실제 환기 비효율성)로 인해 발생한다. 환기동등치의 변화는 AT를 결정하는 추가적인 지표가 되는데, AT는 EqO2가 지속적으로 증가하기 직전의 EqO2의 가장 낮은 지점(nadir)에 해당한다(EqCO2가 동시에 증가하지는 않음)(Fig. 1: panel 4).
V̇E/V̇CO2 기울기는 최대하 운동시 환기(가스 교환) 효율의 측정값이다. 동일한 정보는 패널 4 (EqCO2 ≈ V̇E/V̇CO2)의 비선형 그래프에서도 찾을 수 있지만 값이 동일하지는 않다. V̇E/V̇CO2 기울기는 만성 심부전(CHF)에서의 예후 지표이다(Fig. 1: panel 6).
결론
운동 중 호흡곤란을 겪는 환자들의 문제를 확인하고, 운동 능력의 한계를 정량화할 수 있는 CPET 및 호흡가스분석의 객관적이고 재현 가능한 기회를 제공한다. 이는 폐, 폐혈관, 심혈관 질환을 구별하는 데 도움이 될 뿐만 아니라 근본적인 원인과 종종 복잡한 메커니즘을 밝히는 데도 도움이 된다. 따라서 CPET는 환자가 다양한 진단 검사를 받기 전에 운동 중 발생하는 이상을 찾을 수 있는 광범위한 진단 정밀검사로서 우선적으로 수행되어야 한다. CPET는 비용 효율적일 가능성이 높아 의학계에서 매우 유용한 검사로 간주된다. 더욱이 많은 환자들이 CPET를 임상 검사의 중요한 부분으로 생각하고 있어 이를 더 빈번하게 사용해야 할 것으로 보인다. 최대 이하의 운동 수준에서도 호흡가스를 동시에 측정하므로 매우 유용하다. 그러나 이러한 검사는 CPET 호흡가스분석이 복잡하게 여겨지고 실용적이고 따르기 쉬운 지침을 찾지 못해 복잡한 검사로 여겨지기도 한다. 따라서 CPET의 호흡가스분석 결과를 해석하는 방법을 배우는 데 관심이 있는 사람들을 위한 간결하고 쉽게 접근할 수 있는 소개가 더 필요할 것이다. 이를 통해 CPET의 광범위한 사용이 제한되지 않도록 하는 데에 활용될 수 있을 것으로 기대한다.







